Das Wassermolekül
Wasser unter der Lupe
Aber was genau ist Wasser eigentlich, chemisch und physikalisch betrachtet?
Die chemische Formel für Wasser lautet H2O: Immer zwei Wasserstoffatome (H) und ein Sauerstoffatom (O) sind zu einem Wassermolekül verbunden. Chemisch korrekt müsste man daher auch „Diwasserstoff-Monoxid" statt „Wasser" sagen!
Ein Wassermolekül kann so dargestellt werden:
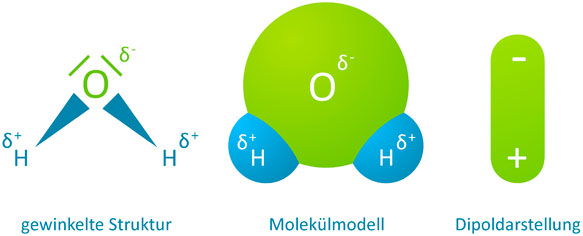
Das Wassermolekül hat eine gewinkelte Struktur. Der Winkel zwischen den beiden Wasserstoffatomen beträgt ca. 104 Grad (°). Diese gewinkelte Struktur ergibt sich aus den zwei nicht bindenden Elektronenpaaren, die das Sauerstoffatom besitzt (diese werden durch die beiden Striche über dem Sauerstoffatom verdeutlicht).
Wassermoleküle sind Dipole
Im Wassermolekül sind je zwei Wasserstoffatome über eine Elektronenpaarbindung an ein Sauerstoffatom gebunden. Die Elektronenpaarbindung besteht aus zwei Elektronen und wird mit einem Strich verdeutlicht.
Ein Maß für die Kraft, die Elektronen der Elektronenpaarbindung an sich zu ziehen, bezeichnet man als Elektronegativität (EN = Maß dafür, wie stark ein Atom gemeinsame Bindungselektronen anzieht). Unterschiedliche Atome weisen einen unterschiedlichen Elektronegativitätswert auf. Das Element mit der höchsten Elektronegativität ist Fluor (EN =4). Sauerstoff hat eine Elektronegativität von 3,5 und Wasserstoff von 2,1. Das wiederum hat Auswirkungen, wenn sich Atome zu einem Molekül zusammenfinden, wie das bei Wasser der Fall ist. Im Wassermolekül hat Sauerstoff also eine größere Elektronegativität als Wasserstoff und zieht damit die Elektronen der beiden Elektronenpaarbindungen an sich auf seine Seite. Somit ergibt sich für das Sauerstoffatom eine negative Teilladung (bezeichnet mit dem altgriechischen Buchstaben „delta“; δ-). Die Wasserstoffatome hingegen erhalten eine positive Teilladung (δ+).
Aus der gewinkelten Struktur und den unterschiedlichen Elektronegativitätswerten von Sauerstoff und Wasserstoff ergibt sich ein negativer Ladungsschwerpunkt auf der Seite des Sauerstoffs und ein postitiver Ladungsschwerpunkt auf der anderen Seite des Wassermoleküls beim Wasserstoff.
Wassermoleküle sind somit ein Dipol bzw. Dipolmolekül (Zweifachpol).
Mit seinen unterschiedlichen Ladungen an den Molekülenden weist Wasser ganz bestimmte elektrische Eigenschaften auf: Dipolmoleküle können nämlich untereinander in Wechselwirkung treten. Dabei nähert sich der positivere Teil (H) dem negativeren Teil (O) eines benachbarten Moleküls und bildet eine Wasserstoffbrückenbindung (in der. Abb. gestrichelt dargestellt).
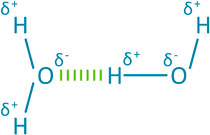
Es entstehen richtige Ketten und die einzelnen Moleküle sind nicht mehr so frei beweglich. Allerdings sind Wasserstoffbrückenbindungen keine besonders feste Bindung, sondern im Vergleich zur Elektronenpaarbindung (also der Bindung zwischen Sauerstoff und Wasserstoff im Wassermolekül) sehr schwache Kräfte.
Trotzdem sind diese Wasserstoffbrückenbindungen verantwortlich für viele Eigenschaften des Wassers:
- den relativ hohen Siedepunkt,
- die Oberflächenspannung,
- den Aggregatzustand bei Raumtemperaturen und
- für die Anomalie des Wassers .