Wasser als Lösungsmittel


Tee
Teeblätter werden nach der Ernte zunächst getrocknet. Im heißen Wasser geben sie dann ihr Aroma und ihre Farbe wieder ab: Es entsteht Tee.
Die in den Teeblättern enthaltenen Stoffe sind also hydrophil.

Öl in Wasser
Öl löst sich nicht in Wasser auf, sondern „schwimmt“ auf dem Wasser. So entstehen zum Beispiel „Fettaugen“ auf der Suppe.
Öle und Fette sind hydrophob.
Im Alltag kannst du häufig feststellen, dass sich Dinge in Wasser lösen: Getrocknete Teeblätter in heißem Wasser geben Aroma und Farbe, es wird Tee, der Zucker im Tee löst sich auf und süßt den Tee.
Auch in unserem Körper funktioniert das Wasser als Lösungsmittel und transportiert damit lebenswichtige Stoffe. Für Wassertiere ist beispielsweise der in Wasser gelöste Sauerstoff lebenswichtig.
Aber: Warum ist Wasser eigentlich so ein gutes Lösungsmittel?
Wieder einmal lohnt sich hier ein Blick in die Chemie:
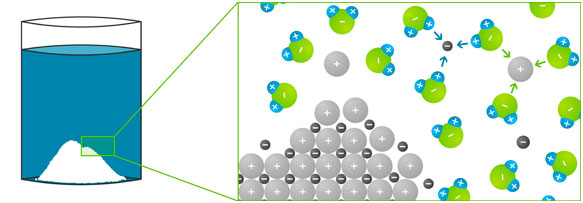
Wasser verdankt seine besonderen Eigenschaften seiner molekularen Struktur: Der relativ einfache Aufbau aus einem Sauerstoff- und zwei Wasserstoffatomen macht Wasser zu einem idealen Lösungsmittel für feste, flüssige und gasförmige Stoffe.
Das Wassermolekül ist nämlich ein „Dipol“ (Zweifachpol): Das Sauerstoffatom hat eine negative Teilladung (bezeichnet mit dem altgriechischen Buchstaben „delta“; δ-), die Wasserstoffatome haben eine positive Teilladung (δ+). Geladene Teilchen wie Salze oder andere polare Flüssigkeiten (z. B. Säuren) lösen sich daher sehr gut im Wasser, weil sich die ungleichen Ladungen gegenseitig anziehen.

Beispiel:
Im festen Salz ordnen sich die positiven und negativen Ionen abwechselnd an, sodass sich ein dreidimensionales Gitter ergibt – das Ionengitter. Kochsalz (= Natriumchlorid) besteht aus positiv geladenen Natrium-Ionen und einem negativ geladenen Chlorid-Ion. Diese ziehen sich gegenseitig an. Wenn man nun Kochsalz in Wasser gibt, passiert Folgendes:
- Die Ionen lösen sich aus ihrer Gitterstruktur und sind im Wasser frei beweglich.
- Die Wassermoleküle umlagern das positive Natrium-Ion so, dass das schwach negativ geladene Sauerstoffatom zum positiven Natrium-Ion zeigt.
- Das negative Chlorid-Ion hingegen wird von den Wassersmolekülen so umlagert, dass die schwach positiv geladenen Wasserstoffatome zu ihm zeigen.
- Die Anlagerung der Wassermoleküle an gelöste Ionen nennt man „Hydratation“.
- Die nun von den Wassermolekülen umschlossenen Ionen lösen sich im Wasser auf.
Wie gut sich feste, flüssige und gasförmige Stoffe im Wasser lösen lassen, ist oft sehr stark von der Temperatur abhängig.
Fette und Öle, die eine große Molekülstruktur haben oder nicht geladen sind, werden vom Wasser abgestoßen. Das kannst du gut beobachten, wenn du zum Beispiel Öl ins Nudelwasser gibst. Das Öl löst sich nicht auf, sondern „schwimmt“ auf dem Wasser.
Wasserlösliche Stoffe bezeichnet man übrigens als „hydrophil“, wasserunlösliche Stoffe als „hydrophob“.